体外诊断试剂注册检验送检须知
发布日期:2020-03-14 19:13:22
一、适用范围
符合《体外诊断试剂注册管理办法》中定义的属医疗器械管理的体外诊断试剂进行注册检验。
二、送检流程图
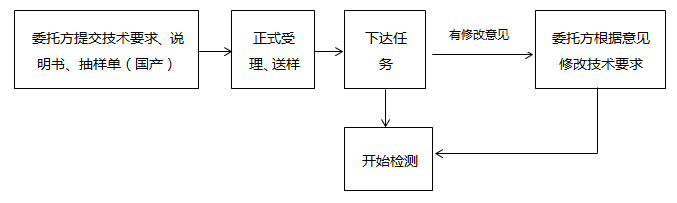
三、技术要求资料提交要求
委托注册检验需提交以下资料,在每份资料上加盖生产企业章,进口企业可加盖中国办事处章。
1. 抽样单(抽样凭证及记录);(国产试剂提供)
2. 产品说明书;
3. 产品技术要求;
4. 标准品、校准品、质控品相关资料。
四、送检样品要求
1. 数量要求
一般情况下,样品数量应为一次检验用量的三倍。特殊情况下(贵重样品、特殊管理的体外诊断试剂等),检品不足三倍量时,不得少于检验及复试用量。
2. 批次要求
a) 第三类产品为连续3批效期内产品,1批到效期产品(根据技术要求提供到效期产品)。
b) 第二类产品为3批效期内产品,1批到效期产品(根据技术要求提供到效期产品)。
3. 样品状态要求:
a) 国产体外诊断试剂应为当地药监局抽取的样品,样品封签应完整无损,签名或印章清晰可辨。
b) 进口体外诊断试剂由申请人自行抽取,送检样品应为成品(内容物应与说明书一致),包装完好,无破损,标志标签清晰可见。
4. 辅助样品要求
a) 提供产品技术要求中要求的在有效期内的质控品、校准品、线性高值样品,数量应能满足所有试验的需要。
b) 如申请检测的试剂需要在专用仪器上进行试验,需请企业提供专用仪器,并提供该仪器设备的计量/校准证明。
五、正式受理需知
1. 填写《医疗器械产品检验委托书》;
应认真填写检验任务委托书,并且产品包装名称、产品技术要求名称、说明书名称三者一致;
2. 提交医疗器械产品技术要求、产品说明书;
3. 送检样品。

